Zwitterione
Nel mondo di oggi, Zwitterione rimane un argomento di costante interesse e dibattito. Con il progresso della tecnologia e della globalizzazione, Zwitterione ha acquisito una rilevanza senza precedenti nella società moderna. Dal suo impatto sull’economia alla sua influenza sulla cultura e sulla politica, Zwitterione è diventato un fenomeno che attraversa tutte le sfere della vita contemporanea. In questo articolo esploreremo le varie sfaccettature di Zwitterione e ne analizzeremo la portata e l'impatto nel mondo di oggi.
Lo zwitterione (dal tedesco Zwitter "ermafrodita"[1]) è una molecola elettricamente neutra che presenta al suo interno un ugual numero di cariche formali positive e negative.[2] Come tale, non subisce l'azione di un campo elettrico e quindi non migra in processi di elettrolisi o di elettroforesi. Il nome zwitterione fu coniato dal chimico tedesco Friedrich Wilhelm Küster nel 1894.
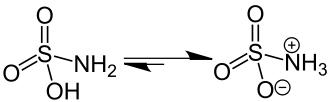
Struttura
Se, al modificarsi del pH, una molecola riesce ad acquisire contemporaneamente due cariche di natura opposta, allora significa che possiede porzioni di sé che si comportano chimicamente in maniera opposta, come fanno un acido e una base. Uno zwitterione è infatti una molecola che ha uno o più sostituenti acidi e lo stesso numero di sostituenti basici.
Gli equilibri delle reazioni di ionizzazione degli zwitterioni sono dipendenti dal pH: a pH acidi i composti tendono a formare cationi, a pH basici tendono a formarsi anioni. Il valore esatto di pH per il quale un composto esiste sotto forma zwitterionica è definito punto isoelettrico.
In genere, i composti che si presentano come zwitterioni sono poco solubili nei solventi organici e abbastanza solubili in acqua, in accordo con la loro natura ionica. Tipiche molecole di questo tipo sono gli amminoacidi.

Amminoacidi
L'equilibrio della reazione di ionizzazione di un amminoacido in acqua è fortemente spostato verso la forma zwitterionica, questo perché il gruppo acido tenderà a dissociarsi secondo la seguente reazione:
mentre il gruppo basico reagirà come segue:
Le costanti di dissociazione acida e basica ( e ) degli amminoacidi proteinogenici misurate sperimentalmente[3][4] confermano che l'equilibrio della reazione globale mostrata in figura, è fortemente spostato verso il prodotto zwitterionico. Anche per quanto riguarda gli amminoacidi non proteinogenici, l'equilibrio di reazione è spostato verso il prodotto.
Altri composti
-
Forma zwitterionica della psilocibina
-
Forma zwitterionica della fosfatidilcolina
-
Forma zwitterionica dell'EDTA
Note
- ^ (DE) Zwitter ▶ Rechtschreibung, Bedeutung, Definition, Herkunft | Duden, su www.duden.de. URL consultato il 13 febbraio 2025.
- ^ (EN) IUPAC Gold Book, "zwitterionic compounds/zwitterions"
- ^ Jacinto Sandoval-Lira, Gustavo Mondragón-Solórzano e Leonardo I. Lugo-Fuentes, Accurate Estimation of pKb Values for Amino Groups from Surface Electrostatic Potential (VS,min) Calculations: The Isoelectric Points of Amino Acids as a Case Study, in Journal of Chemical Information and Modeling, vol. 60, n. 3, 28 febbraio 2020, pp. 1445-1452, DOI:10.1021/acs.jcim.9b01173. URL consultato il 1º agosto 2021.
- ^ (EN) Kateřina Včeláková, Iva Zusková e Ernst Kenndler, Determination of cationic mobilities and pKa values of 22 amino acids by capillary zone electrophoresis, in ELECTROPHORESIS, vol. 25, n. 2, 2004, pp. 309-317, DOI:10.1002/elps.200305751. URL consultato il 1º agosto 2021 (archiviato dall'url originale il 1º agosto 2021).
Altri progetti
 Wikizionario contiene il lemma di dizionario «Zwitterione»
Wikizionario contiene il lemma di dizionario «Zwitterione» Wikimedia Commons contiene immagini o altri file su Zwitterione
Wikimedia Commons contiene immagini o altri file su Zwitterione
Collegamenti esterni
- (EN) zwitterion, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | GND (DE) 4283360-7 |
|---|






